¿Qué tienen en común las células madre del cordón umbilical y las mareas?
 "La gente suele preguntar si las células madre funcionan. Por supuesto que funcionan. Todos somos productos andantes de células madre: el esperma y el óvulo", dijo el venerado doctor James Willerson en una charla en 2011.[1]
"La gente suele preguntar si las células madre funcionan. Por supuesto que funcionan. Todos somos productos andantes de células madre: el esperma y el óvulo", dijo el venerado doctor James Willerson en una charla en 2011.[1]
La moda alimenticia de los adolescentes de Tide Pod, Gronk y la psicología inversa
¿Qué tienen en común dentistas, quiroprácticos, médicos antienvejecimiento, el balneario Four Seasons de Maui y la moda de comer pastillas de marea?

En 2018, la La moda de los adolescentes que comen Tide Pods causó 10 muertes y 37 casos de intoxicación.
Procter and Gamble, fabricante de Tide, pasó a la ofensiva para evitar que los niños se envenenaran.
Incluso contrataron a la superestrella de la NFL Rob Gronkowski para que remontara el partido en el último momento, como había hecho para ganar cuatro Super Bowls con Tom Brady. Sin embargo, La admonición de Gronk a YouTube Tide Pod El resultado fue que más adolescentes aceptaron el reto.
Contaminación, FDA y psicología inversa
El 5 de diciembre de 2019, la FDA advirtió a Liveyon Labs, Inc. que vendían productos de células madre del cordón umbilical contaminados y no autorizados. Al menos 300 pacientes habían notificado infecciones bacterianas relacionadas con los productos de células madre del cordón umbilical de Liveyon.
Un día después, la agencia emitió un comunicado de prensa informar a fabricantes, proveedores y público en general de los problemas de Liveyon y del alcance más amplio de sus preocupaciones. Los otros destinatarios fueron RichSource Stem Cells, Inc., Chara Biologics, Inc.y R3 Stem Cell, LLC. En total, la FDA emitió 350 cartas de advertencia a fabricantes, proveedores sanitarios y clínicas.
El resultado: Cada vez más, quiroprácticos, dentistas, naturópatas, médicos integrales, clínicas de infusión, ortopedistas, etc. tratan a los pacientes con células madre muertas no aprobadas y potencialmente contaminadas.
Quién mató a las células madre Lamentablemente, como relató un paciente de un quiropráctico con Covid larga e insuficiencia cardíaca congestiva: "Probé las células madre del cordón umbilical. No funcionaron". Los estudios revelaron que no había células madre vivas en el producto con el que fue tratado ni en otros viales perinatales disponibles en el mercado:
Lamentablemente, como relató un paciente de un quiropráctico con Covid larga e insuficiencia cardíaca congestiva: "Probé las células madre del cordón umbilical. No funcionaron". Los estudios revelaron que no había células madre vivas en el producto con el que fue tratado ni en otros viales perinatales disponibles en el mercado:
- La viabilidad celular en el producto de sangre de cordón umbilical era inferior a la comunicada por el fabricante, las células eran principalmente leucocitos, no había células madre presentes..."[2]
- El agresivo enfoque de marketing que utilizan actualmente los médicos y las clínicas en relación con diversos productos de tejido de nacimiento como "terapia con células madre" segura y eficaz no está respaldado por la literatura científica existente. [3]
- Las UFC-F, a menudo denominadas células madre, no se encontraron en ninguno de los aloinjertos comerciales de CU (cordón umbilical) analizados, y los clínicos deben desconfiar de las afirmaciones comerciales que afirmen lo contrario. [4]
- El líquido amniótico se ha propuesto como medio alogénico para introducir CMM. Este estudio no ha podido confirmar que los AFP (productos de líquido amniótico) comerciales contengan CMM. [5]
Apetito de riesgo
Pero, ¿qué relación hay entre la moda de comer Tide Pod y la moda de las células madre del cordón umbilical? Los adolescentes de Tide Pod y los pacientes de células madre del cordón umbilical comparten el apetito por el riesgo:
- Cuanto más advertía Proctor and Gamble a los niños del peligro de comer Tide Pods, más rápido crecía la moda.
- Cuanto más advierte la FDA a proveedores y pacientes de los riesgos de las células madre perinatales y sus exosomas, más se está convirtiendo la moda en un frenesí también.
Un estudio de 2016 identificó 351 empresas que promocionan tratamientos con células madre. Cinco años después, el mismo autor estimó que más del cuádruple de empresas (1.480) venden tratamientos con células madre, de las cuales aproximadamente la mitad (781) promocionan tratamientos umbilicales, amnióticos o con exosomas. [6]
Más adelante hablaremos de la asunción de riesgos. En primer lugar, ¿qué son las "células madre perinatales"?
Células madre perinatales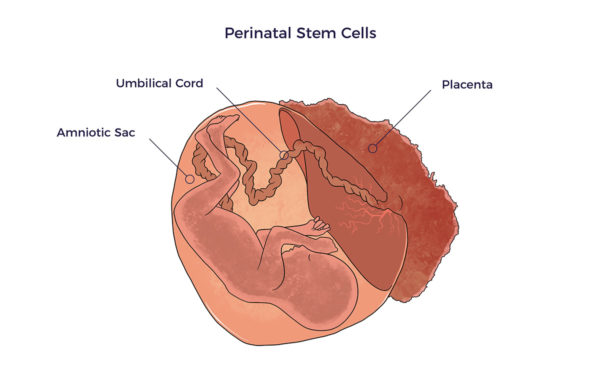 Perinatal se refiere a justo antes o poco después del nacimiento. Así, las células madre perinatales proceden de tejidos o fluidos del nacimiento, es decir, cordón umbilical sangre y tejidos, placenta sangre y tejidos, y amniótico tejidos y fluidos.
Perinatal se refiere a justo antes o poco después del nacimiento. Así, las células madre perinatales proceden de tejidos o fluidos del nacimiento, es decir, cordón umbilical sangre y tejidos, placenta sangre y tejidos, y amniótico tejidos y fluidos.
Eso suena bien a primera vista, pero como se explica en El debate sobre el origen de las célulasLas células madre mesenquimales (CMM) son raras en los tejidos y fluidos del parto. Esta parte de la historia será más detallada a continuación.
Exosomas Las células liberan pequeños sacos o vesículas llamados exosomas. Como palomas mensajeras, los exosomas llevan mensajes a las células cercanas.
Las células liberan pequeños sacos o vesículas llamados exosomas. Como palomas mensajeras, los exosomas llevan mensajes a las células cercanas.
Todas las células con ADN (cancerosas, tisulares, inmunitarias, sanguíneas, etc.) segregan exosomas.
Las células madre mesenquimales (MSC) también las liberan. A pesar de que no se han realizado estudios paralelos en humanos, este mecanismo ha llevado a algunos investigadores y stemcellologists aficionados a creer que son más eficaces que las MSC o ADRC.
Y mientras que una dosis terapéutica de CMM puede ser de 40 a 100 millones de células, los fabricantes de exosomas afirman que sus viales contienen cientos de millones. Un "médico de células madre" del sur de Florida anuncia mil millones de viales de exosomas, sin pruebas de que más sea mejor, ni mucho menos estéril o seguro.
Los técnicos de laboratorio deben multiplicar las MSC o los exosomas en cultivo para obtener una dosis relevante. Sin embargo, el mantenimiento de las Buenas Prácticas de Fabricación vigentes (cGMP) exige el cumplimiento de normas rigurosas.
¿Quién es el autor?

Diez episodios de Wondery, Lote defectuosoilustra los importantes riesgos para la seguridad que el marketing astuto y las prácticas de laboratorio no estériles de Liveyon suponen para los pacientes. En resumen, más de 200 pacientes informaron de efectos adversos graves.
Además, los CDC publicaron sus resultados de laboratorio en el Journal of the American Medical Association (JAMA) en 2021.
Puntos clave
Pregunta ¿Fueron las infecciones en pacientes que recibieron productos de sangre de cordón umbilical comercializados como tratamiento con células madre asociados a la contaminación del producto?
Hallazgos En esta serie de casos20 pacientes de 8 estados desarrollaron infecciones bacterianas tras recibir productos no aprobados comercializados como tratamiento para afecciones que incluyen dolor crónico y afecciones articulares degenerativas. Esta investigación nacional descubrió una contaminación bacteriana generalizada de productos distribuidos y no distribuidos procedentes de múltiples donantes, y la secuenciación del genoma completo indicó una fuente común.
Significado Los resultados de este brote subrayan que los productos de células madre no aprobados ni probados pueden exponer a los pacientes a graves riesgos sin un beneficio claro, incluida la posibilidad de contaminación del producto.
De los productos sin abrir y sin distribuir de los que se tomaron muestras para las pruebas, al menos 1 de 16 especies bacterianas contaminaron 65% (22 de 34 viales). [7]
Reencarnaciones de Liveyon
Sin embargo, las advertencias no consiguieron frenar la marea de células madre del cordón umbilical ni eliminar las células sucias:
- Carta de advertencia del Banco de Cordón Umbilical de Utah de mayo de 2021
- Carta de advertencia de Vitti Health de julio de 2022
- Invitrix Nov 2022 Carta de advertencia
Desde un punto de vista no abordado por la FDA, una revisión global de la literatura científica a través de cuarenta estudios revelaron que "sustancias químicas para siempre" procedentes de plásticos tóxicos estaban presentes en 30.000 muestras de sangre de cordón umbilical.
Además, citando informes de pacientes sobre acontecimientos adversos de un Nebraska exosoma clínica, la FDA emitió una advertencia de seguridad al público.
¿Qué demonios es la artritis reactiva tras una inyección de "células madre"?
Los promotores de los productos de "células madre" perinatales afirman que no hay riesgo de rechazo inmunitario. En otras palabras, afirman que la Jalea de Wharton del cordón umbilical no requiere la compatibilidad del antígeno leucocitario humano (HLA) para emparejar a pacientes y donantes, como se hace en los trasplantes de sangre o médula ósea.
Sin embargo, un informe de un caso no coincidente contradice su falsa afirmación.
"A un hombre de 36 años le inyectaron jalea de Wharton por lumbalgia y en 24 horas desarrolló fiebres, escalofríos, poliartritis y entesitis. (La entesitis es la inflamación de la "entesis", que es donde un tendón o ligamento se une a un hueso..) Las pruebas de enfermedades infecciosas fueron negativas. Los marcadores inflamatorios estaban elevados y su antígeno HLA-B27 era positivo. El tratamiento inicial incluyó metilprednisolona y sulfasalazina. Este caso pone de relieve los peligros desconocidos de estas inyecciones alogénicas y los médicos deben seguir siendo cautelosos sobre su uso hasta que nuevos estudios y regulaciones puedan garantizar la seguridad del paciente."[8]
¿Una penitenciaría abierta?
Si estos productos no están aprobados por la FDA y los laboratorios no cumplen las cGMP, ¿cómo se libran las empresas de venderlos? Los fabricantes afirman que sus productos son para fines de investigación o ignoran la normativa de la FDA porque les importa un bledo.
- Invitrix y Laboratorios Vitti utilice las cláusulas de exención de responsabilidad para ir un paso por delante de la ley.
- Organicell se esconde tras el velo de varios ensayos clínicos de fase 1 previstos o en curso.
Todo el mundo acelera Un médico que quería participar en el salvaje oeste de las células madre preguntó a un abogado especializado en asuntos regulatorios de células madre:
Un médico que quería participar en el salvaje oeste de las células madre preguntó a un abogado especializado en asuntos regulatorios de células madre:
Doctor: Si necesito una autorización reglamentaria para tratar a los pacientes con células madre, ¿cómo es que tantos médicos lo hacen de todos modos?
Abogado: "¿Aceleras?"
Doctor: "Todo el tiempo."
Abogado: "¿Es ilegal?"
Doctor: "No me importa."
Historias como Un jurado condena a un legislador estatal por una trama de fraude COVID-19 en una organización benéfica de atención sanitaria de Springfield y Condenado a 202 años un hombre que decía falsamente utilizar "terapia con células madre no parecen marcar la diferencia.
Células madre y exosomas para sanos y ricos
SiguienteSalud en el Four Seasons Maui Resort mezcla la manía, ofreciendo "células madre" de cordón umbilical potencialmente contaminadas de Vitti Labs y exosomas no aprobados de Organicell en su spa. Ofrecen Células Madre + Exosomas + Terapia IV de Longevidad por $.16.000, un ahorro de $2.299.
 En contra de las cartas de advertencia de la FDA, una coordinadora de pacientes de NextHealth insistió en que los productos de Vitti y Organicell están aprobados por la FDA y que los fabricantes certifican que todos los lotes están libres de contaminantes. ¿De dónde sacó esa idea?
En contra de las cartas de advertencia de la FDA, una coordinadora de pacientes de NextHealth insistió en que los productos de Vitti y Organicell están aprobados por la FDA y que los fabricantes certifican que todos los lotes están libres de contaminantes. ¿De dónde sacó esa idea?
Desde otro punto de vista, el hecho de que algo sea ilegal no significa que los hábiles comercializadores asociados con marcas emblemáticas como el Four Seasons hayan consultado a un abogado especializado en el cumplimiento de la FDA. O que hayan leído la bibliografía aquí citada.
El distribuidor de células madre amplía las consultas dentales En el otro extremo del espectro, Nueva vidaInvitrix, distribuidor de Invitrix y Organicell, "colabora estrechamente con médicos y profesionales para mejorar su oferta asistencial... y ampliar sus consultas con "biológicos naturales (énfasis añadido)". Pero su página de productos de investigación y un descargo de responsabilidad informan a sus clientes -dentistas, quiroprácticos, enfermeros y médicos- de que sus productos no están aprobados por la FDA.
En el otro extremo del espectro, Nueva vidaInvitrix, distribuidor de Invitrix y Organicell, "colabora estrechamente con médicos y profesionales para mejorar su oferta asistencial... y ampliar sus consultas con "biológicos naturales (énfasis añadido)". Pero su página de productos de investigación y un descargo de responsabilidad informan a sus clientes -dentistas, quiroprácticos, enfermeros y médicos- de que sus productos no están aprobados por la FDA.
¿Funcionan las células madre? "Por supuesto, funcionan. Todos somos productos andantes de células madre: el esperma y el óvulo". James Willerson, MD, Ph.D. El Dr. Willerson llegó a publicar Buying New Soul (2012). Aquí planteó la hipótesis de que el tejido adiposo era la mejor fuente de células madre adultas.
"Por supuesto, funcionan. Todos somos productos andantes de células madre: el esperma y el óvulo". James Willerson, MD, Ph.D. El Dr. Willerson llegó a publicar Buying New Soul (2012). Aquí planteó la hipótesis de que el tejido adiposo era la mejor fuente de células madre adultas.
Cada vez son más los estudios que respaldan la hipótesis de Willerson: Búsqueda en PubMed Central devuelve más de 100.000 publicaciones en las que se habla de células madre derivadas del tejido adiposo. Y más de 35 estudios publicados sobre el sistema Celution en humanos validar la seguridad y eficacia de los ADRC de grado clínico.
Por el contrario, experimentar con pacientes en consultas dentales o en hoteles de lujo con "productos biológicos naturales" potencialmente contaminados que contienen células madre muertas es una vaina arriesgada para los pacientes.
[2] Fortier LA, Cercone M, Keller LE, Delco ML, Becktell L, Wells KV. Amnion and Umbilical Cord-Derived Products in Sports Medicine: From Basic Science to Clinical Application. Revista Americana de Medicina Deportiva. 2021;49(7):1954-1961
[3]https://legislature.vermont.gov/Documents/2020/WorkGroups/Senate%20Health%20and%20Welfare/Bills/S.252/Written%20Testimony/S.252~Jonathan%20Fenton~Consensus%20Statement%20on%20Aggressive%20Marketing%20of%20Birth%20Tissues%20as%20Stem%20Cell%20Therapies~2-28-2020.pdf
[4] Berger DR, Centeno CJ, Kisiday JD, McIlwraith CW, Steinmetz NJ. Colony Forming Potential and Protein Composition of Commercial Umbilical Cord Allograft Products in Comparison with Autologous Orthobiologics. Am J Sports Med. 2021 Oct;49(12):3404-3413.
[5] Panero AJ, Hirahara AM, Andersen WJ, Rothenberg J, Fierro F. ¿Son los productos de líquido amniótico terapias con células madre? A Study of Amniotic Fluid Preparations for Mesenchymal Stem Cells with Bone Marrow Comparison. Revista americana de medicina deportiva. 2019;47(5):1230-1235.
[6] Turner L La venta americana de células madre en 2021: Las empresas estadounidenses que venden intervenciones con células madre sin licencia y no probadas Cell Stem Cell 28, 4 de noviembre de 2021
[7] Hartnett KP, Powell KM, Rankin D, et al. Investigation of Bacterial Infections Among Patients Treated with Umbilical Cord Blood-Derived Products Marketed as Stem Cell Therapies. Red abierta de JAMA.2021;4(10): e2128615.
[8] Madhoun et al. Inducción de artritis reactiva asociada a HLA-B27 tras una inyección de "células madre" de gelatina de Wharton Am J Phys Med Rehabil 2020;99:e142-e145






