Terapia celular AMBROSE para la enfermedad renal
En 2010, como es habitual en un nuevo campo de investigación, un grupo de científicos realizó un estudio con animales para probar la posible seguridad y eficacia de las células madre y regenerativas derivadas del tejido adiposo (de la grasa) para tratar la enfermedad renal aguda.
Los resultados fueron sorprendentemente positivos, demostrando que el tratamiento con ADRC redujo drásticamente la mortalidad, ya que 100% de los ratones tratados sobrevivieron frente a 57% que recibieron el placebo (controles). Asimismo, los ratones tratados presentaron niveles de creatinina sérica significativamente reducidos frente a los controles.[1] Desde entonces, otros estudios sobre la enfermedad renal aguda y crónica en animales pequeños y grandes, así como en humanos, han demostrado que las células madre adultas y otras células regenerativas del tejido adiposo pueden ayudar a prevenir la progresión de la enfermedad, reducir los niveles séricos de creatinina, revertir la cicatriz fibrosa (fibrosis) y mejorar el flujo sanguíneo.[2] [3] [4] Los estudios en humanos también han demostrado una mejora de la función renal tras el tratamiento con células madre.[5]
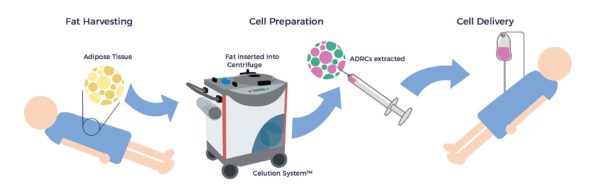
Células madre y regenerativas derivadas del tejido adiposo (ADRC)
La grasa corporal, conocida médicamente como tejido adiposo, es una fuente atractiva de células madre y regenerativas debido a su accesibilidad, abundancia y potencia en comparación con otras fuentes de tejidos como la médula ósea, el cordón umbilical y la placenta. Las ADRC pueden extraerse, procesarse y reinyectarse a pie de cama en el mismo día y, gracias a sus múltiples actividades biológicas, se han utilizado para mejorar los síntomas, la función y la calidad de vida en una amplia gama de afecciones, como la enfermedad renal aguda y crónica.[6] [7]
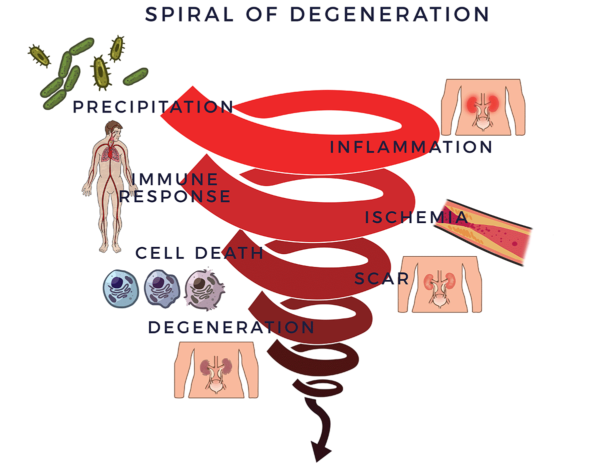
Espiral de degeneración
Las afecciones degenerativas crónicas, incluida la insuficiencia renal, siguen un patrón similar en su proceso de enfermedad.
Los traumatismos, las infecciones, las toxinas ambientales, los hábitos de vida poco saludables (por ejemplo, fumar), los factores hereditarios o una combinación de estos factores negativos pueden desencadenar una respuesta inflamatoria. Este tipo de inflamación (aguda) es esencial para la reparación del organismo y suele ser de corta duración, desapareciendo una vez que se ha producido el proceso de curación.
Existe otro tipo de respuesta inflamatoria persistente que se vuelve crónica y afecta a todo el organismo, convirtiéndose en sistémica.[8] La inflamación sistémica es un factor común en las enfermedades del envejecimiento, que abarcan un amplio espectro de afecciones graves, debilitantes y, en ocasiones, potencialmente mortales, incluida la insuficiencia renal.[9] [10]
En el caso de las enfermedades degenerativas, la inflamación crónica inicia un proceso degenerativo vicioso. Recluta al sistema inmunitario, que está ahí para luchar contra las infecciones y otros procesos de enfermedad, y para ayudar a la curación. Las células del sistema inmunitario (células inmunitarias) están ahí para proteger el cuerpo. Cuando detectan al enemigo, envían tropas de moléculas proinflamatorias llamadas “citoquinas” para combatirlo. Cuando este proceso se descontrola, se denomina respuesta inflamatoria-inmunitaria. Esta respuesta equivale a tener un conductor en el asiento trasero que reacciona de forma exagerada de forma crónica mientras le “ayuda” a conducir su coche. La respuesta inmunitaria provoca una reducción del flujo sanguíneo (isquemia). Sin una buena circulación, las células mueren, se forman cicatrices y fibrosis, y los tejidos y órganos degeneran. Llamamos a esto la Espiral de Degeneración, ya que la utilizamos como marco para comprender algunos de los factores clave de la enfermedad renal.
La pérdida de la función renal se corresponde con una inflamación que afecta al sistema de filtración renal (riñón) y a sus pequeños vasos sanguíneos. Es bien sabido que la enfermedad renal crónica está asociada a la diabetes y a la hipertensión arterial no controlada, empeorando gradualmente la función renal con el paso del tiempo. Las primeras fases suelen ser asintomáticas. La enfermedad renal aguda puede ser provocada rápidamente por un estado insuficiente de líquidos (debido a diversas afecciones) y por algunos medicamentos.
Proceso de reparación
A través de un mecanismo de comunicación entre células conocido como efecto paracrino, las ADRC movilizan a las células cercanas para que trabajen con mayor eficacia. Reclutan a los departamentos biológicos de bomberos, rescate y reparación del lugar -las células madre residentes- para que se pongan manos a la obra y hagan su parte.
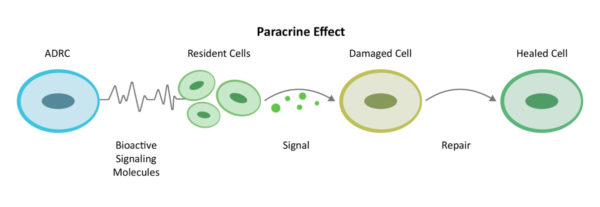
Reclutando "reparadores" adicionales en el lugar (células madre residentes) para que vuelvan al trabajo y hagan su parte, los ADRC reúnen un equipo ampliado y trabajan primero para disminuir la inflamación y las respuestas inmunitarias hiperactivas. Una vez que disminuye la conducción en el asiento trasero, continúan su trabajo aumentando la circulación con el crecimiento de nuevos vasos sanguíneos, evitando una mayor muerte celular, abordando el tejido cicatricial y regenerando el tejido sano y los nervios. Así es como el cuerpo se cura de forma natural, pero si la agresión de una enfermedad aguda o crónica es demasiado grande, necesita ayuda.
A esto lo llamamos Proceso de Reparación. Incluye los múltiples mecanismos de acción necesarios para devolver el equilibrio a la inflamación sistémica y a la respuesta inmunitaria.
Terapia celular AMBROSE para la enfermedad renal
Dado que los principales factores de la espiral mencionados anteriormente están implicados en la insuficiencia renal y que los múltiples mecanismos de reparación de los ADRC han demostrado revertir esos efectos en esta enfermedad, así como en otras afecciones graves, los pacientes con enfermedad renal pueden beneficiarse potencialmente de la terapia celular AMBROSE.
Estudios con animales han demostrado que las células madre reducen la lesión renal aguda al activar glóbulos blancos especializados que inician la cicatrización y reparación del tejido renal, y protegen contra el envejecimiento celular prematuro.[11] [12] [13]
Asimismo, se ha demostrado que el tratamiento con células madre de la enfermedad renal crónica animal favorece la recuperación de la producción de energía de las células renales[14] [15], disminuir la cicatrización[16], y disminuir la inflamación.[17]
La terapia celular AMBROSE representa una opción de tratamiento mínimamente invasivo para pacientes con enfermedad renal. Póngase en contacto con nosotros para obtener más información sobre el tratamiento, la candidatura y cómo convertirse en paciente.
[1] Z Feng et al Fresh and cryopreserved, uncultured adipose tissue-derived stem and regenerative cells ameliorate ischemia-reperfusion-induced acute kidney injury, Nefrología Diálisis Trasplante, Volume 25, Issue 12, 1 December 2010, Pages 3874-3884
[2] C Donizetti-Oliveira El tratamiento con células madre derivadas de tejido adiposo previene la progresión de la enfermedad renal Cell Transplantation, Vol. 21, pp. 1727-1741, 2012
[3] A Eirin et al Adipose tissue-derived mesenchymal stem cells improve revascularization outcomes to restore renal function in swine atherosclerotic renal artery stenosis Stem Cells. 2012 Mayo; 30(5): 1030-1041
[4] JJ Rivera-Valdés et al. (2017) Human adipose derived stem cells regress fibrosis in a chronic renal fibrotic model induced by adenine. PLoS ONE 12(12)
[5] El-Ansary M, Saadi G, Abd El-Hamid SM. Las células madre mesenquimales son un enfoque de rescate para la recuperación de la función renal deteriorada. Nefrología 2012;17:650-657.
[6] Guo et al Fracción vascular estromal: ¿Una realidad regenerativa? Parte 2: Conceptos actuales y revisión de la literatura Journal of Plastic, Reconstructive & Aesthetic Surgery (2016) 69, 180e188.
[7] JK Fraser PhD y S Kesten MD Células regenerativas autólogas derivadas de tejido adiposo: Una plataforma para aplicaciones terapéuticas Advanced Wound Healing Surgical Technology International XXIX
[8] S. Amor Inflammation in neurodegenerative diseases Immunology, 129, 154-169
[9] C. Franceschi and J. Campisi Chronic Inflammation (Inflammaging) and Its Potential Contribution to Age-Associated Diseases J Gerontol A Biol Sci Med Sci 2014 June;69(S1): S4-S9
[10] Suliman ME, Stenvinkel P. Contribución de la inflamación a la enfermedad vascular en pacientes con insuficiencia renal crónica. Saudi J Kidney Dis Transpl 2008;19:329-45
[11] Geng, Y.; Zhang, L.; Fu, B.; Zhang, J.; Hong, Q.; Hu, J.; Li, D.; Luo, C.; Cui, S.; Zhu, F.; et al. Mesenchymal stem cells ameliorate rhabdomyolysis-induced acute kidney injury via the activation of m2 macrophages. Stem Cell Res. Ther. 2014, 5, 80
[12] Lee, S.J.; Ryu, M.O.; Seo, M.S.; Park, S.B.; Ahn, J.O.; Han, S.M.; Kang, K.S.; Bhang, D.H.; Youn, H.Y. Mesenchymal stem cells contribute to improvement of renal function in a canine kidney injury model. In Vivo 2017, 31, 1115-1124
[13] Rodrigues, C.E.; Capcha, J.M.; de Braganca, A.C.; Sanches, T.R.; Gouveia, P.Q.; de Oliveira, P.A.; Malheiros, D.M.; Volpini, R.A.; Santinho, M.A.; Santana, B.A.; et al. Human umbilical cord-derived mesenchymal stromal cells protect against premature renal senescence resulting from oxidative stress in rats with acute kidney injury. Stem Cell Res. Ther. 2017, 8, 19
[14] Yoon, Y.M.; Han, Y.S.; Yun, C.W.; Lee, J.H.; Kim, R.; Lee, S.H. Pioglitazone protects mesenchymal stem cells against p-cresol-induced mitochondrial dysfunction via up-regulation of pink-1. Int. J. Mol. Sci. 2018, 19, 2898
[15] Lira, R.; Oliveira, M.; Martins, M.; Silva, C.; Carvalho, S.; Stumbo, A.C.; Cortez, E.; Verdoorn, K.; Einicker-Lamas, M.; Thole, A.; et al. Transplantation of bone marrow-derived mscs improves renal function and na(+)+k(+)-atpase activity in rats with renovascular hypertension. Cell Tissue Res. 2017, 369, 287-301
[16] Wu, H.J.; Yiu, W.H.; Li, R.X.; Wong, D.W.; Leung, J.C.; Chan, L.Y.; Zhang, Y.; Lian, Q.; Lin, M.; Tse, H.F.; et al. Mesenchymal stem cells modulate albumin-induced renal tubular inflammation and fibrosis. PLoS ONE 2014, 9, e90883
[17] Abdel Aziz, M.T.; Wassef, M.A.; Ahmed, H.H.; Rashed, L.; Mahfouz, S.; Aly, M.I.; Hussein, R.E.; Abdelaziz, M. The role of bone marrow derived-mesenchymal stem cells in attenuation of kidney function in rats with diabetic nephropathy. Diabetol. Metab. Syndr. 2014, 6, 34