علاج AMBROSE بالخلايا للأمراض العصبية التنكسية
خلال عقود من الأبحاث، ازداد فهمنا للحالات العصبية التنكسية بشكل ملحوظ. فقد تم الربط بشكل أوضح بين بعض العوامل الرئيسية الموجودة لدى المرضى الذين تعرضوا لإصابة دماغية رضحية أو الذين يعانون من أمراض مثل الخرف أو الزهايمر أو باركنسون.
في السنوات الأخيرة، تم تقدير الالتهاب بشكل متزايد على أنه جزء من السبب من التنكس العصبي وليس مجرد نتيجة له. لقد غيرت هذه الاكتشافات المهمة المنشورة في الأدبيات العلمية الطريقة التي ننظر بها إلى الأمراض المرتبطة بالدماغ، وبالتالي الطريقة التي يمكن بها علاجها.
الالتهاب الجهازي والتدهور المعرفي
يُعد الالتهاب الجهازي عاملاً شائعاً في أمراض الشيخوخة - وهو يغطي طيفاً واسعاً من الحالات المرضية الشديدة والموهنة وأحياناً المهددة للحياة.[1] يدرك العلماء الذين يبحثون في أمراض الدماغ الآن على نطاق واسع أن الالتهاب المنتشر على نطاق واسع متورط في العملية الضارة لمرض باركنسون[2] وكذلك الخرف، وتحديدًا أكثر أشكاله انتشارًا وهو مرض الزهايمر (AD).[3]
أثبتت دراسة مفيدة أجريت في عام 2009 وجود علاقة قوية بين مستويات الالتهاب والأعراض. تم تقييم 300 مريض من مرضى الزهايمر الخفيف إلى الحاد بمساعدة مقدمي الرعاية لهم لمعرفة المستوى الأساسي للوظيفة الإدراكية، واختبار مستويات جزيء (سيتوكين) يسبب الالتهاب (مؤيد للالتهاب) يسمى عامل نخر الورم-ألفا (TNF-a).
ثم سجل الباحثون بعد ذلك أي حدث التهابي جهازي حاد جديد، مثل مرض أو صدمة جسدية حدثت بعد الاختبار الأولي وأعادوا اختبار الوظيفة الإدراكية ومستويات عامل التفاعلات الثنائية الفينيل المتعدد-ألف عند شهرين و4 و6 أشهر لمقارنتها بالمستويات الأساسية التي لوحظت في بداية الدراسة. وكانت النتيجة النهائية هي أن كلاً من الالتهاب الجهازي الحاد والمزمن، كما تم قياسه من خلال زيادة مستويات عامل النيتروزين أحادي العامل-أ، يرتبط ارتباطاً وثيقاً بزيادة التدهور المعرفي لدى المرضى في الدراسة.[4]
الاستجابة الالتهابية-المناعية
يبدأ الخلل الوظيفي العصبي بمحفز مثل الصدمة (كما هو الحال في الملاكمة أو غيرها من إصابات الدماغ الرضحية) أو السكتة الدماغية أو العدوى أو خيارات نمط الحياة (مثل التدخين) أو السموم البيئية أو العوامل الوراثية أو مزيج من هذه العوامل. يؤدي واحد أو أكثر من هذه العوامل إلى التهاب الأعصاب[5]يُعرّف بأنه التهاب مزمن ومستمر في الجهاز العصبي المركزي والدماغ.
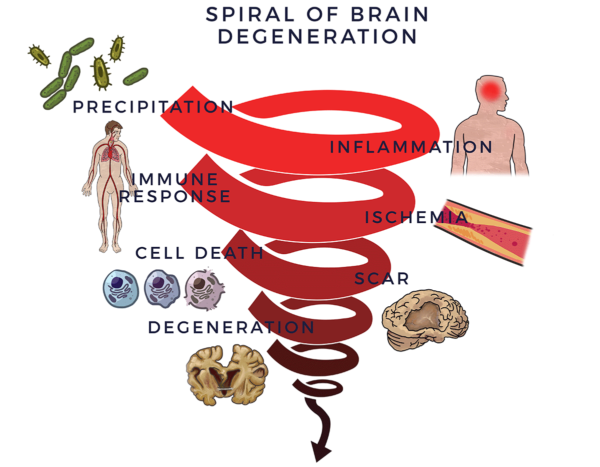
ومن أجل حماية الدماغ، يقوم الجهاز المناعي بتحريك الاستجابة المناعية. عندما تخرج هذه العملية عن نطاق السيطرة، تصبح الاستجابة المناعية بمثابة وجود سائق في المقعد الخلفي يبالغ في رد فعله بشكل مزمن أثناء "مساعدتك" في قيادة سيارتك. ويسمى هذا أيضًا الاستجابة المناعية الالتهابية ويؤدي إلى انخفاض تدفق الدم (نقص التروية) في الدماغ. بدون دورة دموية جيدة تجلب الأكسجين والمواد المغذية الأساسية للحفاظ على صحة الدماغ[6]تموت الخلايا العصبية وتحل الندوب أو اللويحات أو البروتينات محل الأنسجة السليمة ويتدهور الدماغ. نطلق على هذه العملية اسم "دوامة التنكس".
يؤثر فقدان الخلايا العصبية (الخلايا العصبية) على التوازن والحركات والكلام والتنفس والذاكرة بطرق مختلفة وفي أوقات زمنية مختلفة حسب التشخيص المحدد ومعدل التدهور. يعزى مرض باركنسون إلى فقدان الخلايا العصبية التي تنتج مادة كيميائية تسمى الدوبامين في الدماغ. يتسبب نقص الدوبامين في حدوث رعشة واضطرابات في التوازن والحركة والكلام. ويمكن أن يؤدي أيضاً إلى الاكتئاب وضعف الذاكرة.
يتزايد الاعتراف بعوامل اللولب الحلزوني التي تؤدي إلى ظهور الأعراض وتراجع أنشطة الحياة اليومية التي تنتج عن الأمراض المرتبطة بالدماغ. [7] [8] [9]
الدماغ عضو مرن بشكل لا يصدق. وبحلول الوقت الذي تظهر فيه حالة مثل مرض باركنسون أو الخرف (وما يرتبط به من لويحات الأميلويد أو بروتينات تاو أو أجسام ليوي)، قد تكون هذه الأشياء قد تطورت على مدى عقد أو أكثر في تسلسل أحداث متفاقمة تدريجيًا.
عملية الإصلاح
من خلال آلية اتصال من خلية إلى خلية تُعرف باسم إشارات الباراكرين[10]، تعمل الخلايا الجذعية والتجديدية المشتقة من الدهون (ADRCs) على تعبئة الخلايا القريبة لتعمل بكفاءة أكبر.
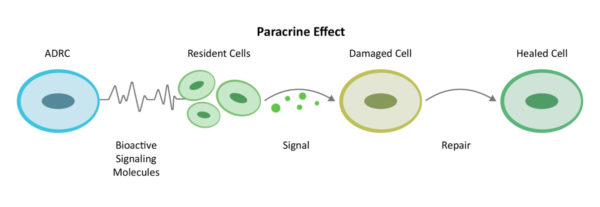
كما تنشط الخلايا المقيمة الموجودة بالفعل في موقع الالتهاب والإصابة في الدماغ - ولكنها نائمة أثناء العمل - لتعود إلى العمل لتقوم بدورها. تقوم هذه الخلايا المقيمة أولاً بتقليل الالتهاب والاستجابات المناعية المفرطة النشاط. وبمجرد أن تهدأ القيادة الخلفية من الجهاز المناعي، فإنها تزيد من الدورة الدموية بنمو أوعية دموية جديدة وتعيد الصحة إلى الأوعية الدموية الموجودة، وتمنع المزيد من الموت المبرمج للخلايا (موت الخلايا المبرمج)، وتقلل من حجم الندبة، وأخيراً تجدد الأنسجة والأعصاب السليمة.
ونحن نسمي هذه العملية بعملية الإصلاح. يتعافى الجسم بشكل طبيعي من الإصابة بهذه الطريقة، ويتم دعم عمليات الشفاء بشكل أكبر من خلال آليات العمل المتعددة لـ ADRCs نحو هدف الإصلاح والتجديد في الدماغ وكذلك السيطرة على الالتهاب الجهازي.
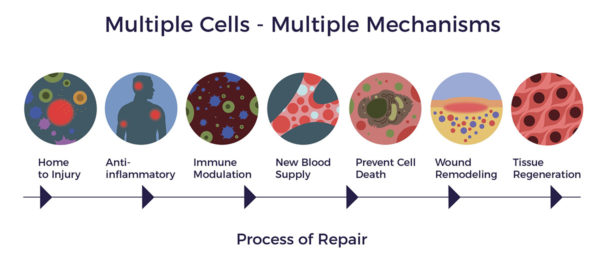
وكنتيجة للأنشطة المتعددة التي تقوم بها مراكز أبحاث الخلايا الجذعية في الدماغ، يمكن أن تتشكل أوعية دموية جديدة وتتولد خلايا عصبية جديدة في الدماغ.[11] [12] كما هو موضح في دراسة حديثة أجريت على الحيوانات، فقد لوحظ أيضًا أن مركبات ADRCs تقلل من الآفات في الدماغ (كما في حالات السكتة الدماغية أو إصابات الدماغ) وبالتالي تؤثر إيجابًا على التعلم والذاكرة.[13]
خلايا متعددة، وظائف متعددة
وعلى عكس العقاقير الدوائية التي تعتمد على جزيء واحد أو مادة كيميائية واحدة لإخضاع العامل الأبرز في المرض - مثل الأدوية العديدة التي تم تطويرها لمعالجة تراكم الأميلويد، والتي فشلت جميعها في التجارب السريرية - فإن الأدوية المضادة للأدوية المضادة للأدوية تغطي الأنسجة أو الأعضاء المريضة بمئات الجزيئات النشطة بيولوجيًا التي تعزز إصلاح الخلايا والأعصاب والأنسجة عند الحاجة.[14] [15] وبعبارة أخرى، نحن لا نعتمد على لاعب نجم ذو تخصص محدد، بل على فريق كامل من اللاعبين ذوي الكفاءة المتساوية.
تفرز الخلايا الجذعية الوسيطة الوسيطة (MSCs)، وهي نوع من الخلايا الجذعية الموجودة في الدهون، مواد كيميائية وعوامل نمو مفيدة معروفة بتعزيز بقاء الخلايا العصبية وتجديدها من خلال الإشارات الباراكرينية. وهذه وظيفة مهمة تعزز جوانب مختلفة من التعافي في الدماغ المصاب من خلال تقليل موت الخلايا وزيادة نمو الأنسجة العصبية الجديدة وكذلك تكوين أوعية دموية جديدة.[16]
وتسمى مجموعة مهمة من الجزيئات النشطة بيولوجيًا التي يتم إطلاقها من الخلايا العصبية النامية عوامل التغذية العصبية (NTFs)؛ "عصبية" تتعلق بالعصب و"تغذوية" من اليونانية القديمة trophikós التي تعني "تتعلق بالغذاء أو التغذية". تدعم NTFs نمو الخلايا العصبية النامية والناضجة (الخلايا العصبية) وبقاءها وتمايزها. وقد ثبت أن الخلايا الجذعية المشتقة من الخلايا الجذعية الدهنية (ADSCs) تفرز عامل النمو العصبي المشتق من الدماغ (BDNF) الذي يعزز التئام الأعصاب ونمو المحاور العصبية.[17] [18] [19] [20]
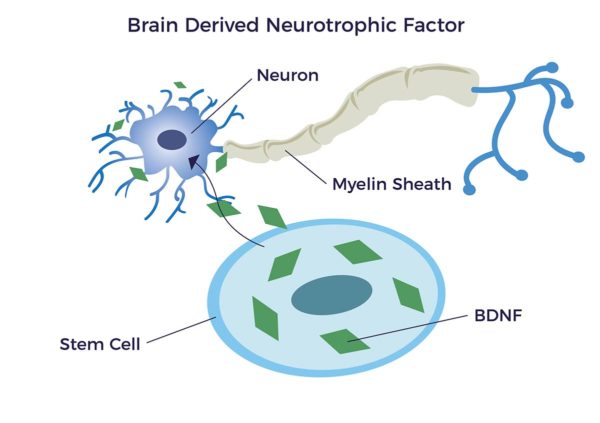 ترتبط المستويات المرتفعة من BDNF بزيادة الذكاء والمزاج والإنتاجية والذاكرة إلى جانب انخفاض مخاطر الإصابة بالخرف ومرض الزهايمر.
ترتبط المستويات المرتفعة من BDNF بزيادة الذكاء والمزاج والإنتاجية والذاكرة إلى جانب انخفاض مخاطر الإصابة بالخرف ومرض الزهايمر.
تخلل الحاجز الدموي الدماغي الدموي الدماغي
يقف الحاجز الدماغي الدموي الدماغي (BBB) الذي تتمثل مهمته في العمل كمرشح والحفاظ على بيئة مستقرة للدماغ. في علاج الاضطرابات التنكسية العصبية، يقوم أطباء AMBROSE بإعطاء جرعة منخفضة من المانيتول، وهو كحول سكري، عن طريق الوريد قبل ضخ الخلايا الجذعية. يفتح مانيتول حاجز الدم في الدماغ مؤقتاً بحيث يمكن لنسبة أعلى بكثير من الخلايا أن تهاجر بأمان إلى الدماغ[21] وهو ما يستخدمه الأطباء في البداية لتخليص الدماغ من السوائل الزائدة أو الالتهابات وكذلك قبل التسريب الوريدي لأدوية السرطان.
العلاج الخلوي AMBROSE لإصابات الدماغ واضطرابات التنكس العصبي
الخلايا الجذعية والتجديدية المشتقة من الدهون هي مجموعة متنوعة من الخلايا التي لديها القدرة على المساعدة في تحسين الأعراض والوظائف وجودة الحياة للمرضى الذين يعانون من اضطرابات مرتبطة بالدماغ أو الذين تعرضوا لإصابة دماغية رضحية.[22] [23]
تشبه هذه الخلايا وجود طاقم إطفاء وإنقاذ وإصلاح شخصي مخصص للإطفاء والإنقاذ والإصلاح يتواجد بشكل طبيعي في جسمك. فهي تنتظر بهدوء إشارة وجود مشكلة - أي الالتهاب - ثم تعود إلى المنزل لتقوم بعملها.
من خلال تسخير قوة بيولوجيتك الخاصة، يمثل العلاج بالخلايا AMBROSE خياراً طفيف التوغل للمرضى الذين يعانون من حالات تنكسية عصبية مثل باركنسون والخرف ومرض الزهايمر، أو بعد السكتة الدماغية أو إصابات الدماغ الرضحية.
من فضلك اتصل بنا للمزيد من المعلومات حول العلاج والترشح وكيفية أن تصبح مريضاً.
[1] C. Franceschi and J. Campisi الالتهاب المزمن (الالتهاب) ومساهمته المحتملة في الأمراض المرتبطة بالعمر J Gerontol A Biol Sci Med Sci 2014 June;69(S1): S4-S9
[2] C. فيراري و ر. تاريلي. مرض باركنسون والالتهاب الجهازي مرض باركنسون. 2011; 2011: 436813.
[3] آر شميدت وإتش شميدت وآخرون الالتهاب المبكر والخرف: متابعة لمدة 25 عامًا لدراسة هونولولو-آسيا للشيخوخة. 2002 حوليات طب الأعصاب. 52. 168-74. 10.1002/ana.10265.
[4] C. هولمز وآخرون الالتهاب الجهازي وتطور المرض في مرض الزهايمر طب الأعصاب 2009؛ 73:768-774
[6] E Hirsch و S Hunot الالتهاب العصبي في مرض باركنسون: هدف للحماية العصبية؟ Lancet Neurol 2009؛ 8: 382-97
[6] آر إن كالاريا (2010). الأساس الوعائي لتنكس الدماغ: ضوابط التعثر وعوامل خطر الإصابة بالخرف. مراجعات التغذية, 68(ملحق 2)، S74-S87
[7] بي في زلوكوفيتش المسارات العصبية الوعائية للتنكس العصبي في مرض الزهايمر والاضطرابات الأخرى. مراجعات الطبيعة لعلم الأعصاب. 2011;12(12):723-738
[8] ليندا ج. فان إيلديك وآخرون أدوار الالتهاب وآليات المناعة في مرض الزهايمر مرض الزهايمر والخرف: البحوث الانتقالية والتدخلات السريرية 2 (2016) 99-109
[9] Kim S, Chang K-A, Kim Ja, Park H-G, Ra JC, et al. (2012) التأثيرات الوقائية والعلاجية للخلايا الجذعية البشرية المشتقة من الدهون البشرية عن طريق الوريد في فئران مرض الزهايمر. PLoS ONE 7 (9): e45757.
[10] أ. كابلان MSCs: الحارس والحراس الآمنون للإصابة J. Cell. Physiol. 231: 1413-1416, 2016
[11] J. ك. هوانغ وآخرون تجديد المايلين في التصلب المتعدد: استهداف. الخلايا الجذعية الذاتية المنشأ، الجمعية الأمريكية للعلاجات العصبية التجريبية، 2011
[12] A Bowles et al التأثيرات المناعية لخلايا الأجزاء الوعائية اللحمية الدهنية اللحمية التي تعزز التنشيط البديل للخلايا البلعمية الكبيرة لإصلاح تلف الأنسجة. الخلايا الجذعية، 2017 أغسطس 12
[13] Zhou F، Gao S، Wang L، وآخرون. تنقذ الخلايا الجذعية البشرية المشتقة من الدهون المشتقة من الخلايا الجذعية البشرية جزئيًا متلازمات السكتة الدماغية من خلال تعزيز التعلم المكاني والذاكرة في نموذج انسداد الشريان الدماغي الأوسط للفأر [يظهر التصحيح المنشور في Stem Cell Res Ther. 2019 مارس 6؛ 10(1):76]. أبحاث الخلايا الجذعية. 2015;6(1):92. نشرت 2015 مايو 9. 2015 مايو 9. doi:10.1186/s13287-015-0078-1
[14] تاكيشي تكسودا وآخرون تفرز الخلايا الجذعية الوسيطة اللُّحمية المتوسطة المشتقة من الأنسجة الدهنية البشرية إكسوسومات وظيفية مرتبطة بالنيبريليسين التقارير العلمية 3: 1197
[15] أ. بريني وآخرون، التأثير العلاجي للخلايا الجذعية البشرية المشتقة من الخلايا الجذعية الدهنية وإفرازاتها في آلام السكري التجريبية التقارير العلمية 7: 9904
[16] C. تيت وسي كيس. الخلايا اللحمية الوسيطة لعلاج إصابات الدماغ. موضوعات متقدمة في الاضطرابات العصبية.
[17] رازافي، شاهناز وآخرون. "عوامل التغذية العصبية وتأثيراتها في علاج التصلب المتعدد." الأبحاث الطبية الحيوية المتقدمة 4 (2015): 53. شركة بي إم سي. الويب. 28 سبتمبر 2018.
[18] J. ك. هوانغ وآخرون تجديد المايلين في التصلب المتعدد: استهداف. الخلايا الجذعية الذاتية المنشأ، الجمعية الأمريكية للعلاجات العصبية التجريبية، 2011
[19] تي لوباتينا وآخرون. (2011) تحفز الخلايا الجذعية المشتقة من الدهون المشتقة من الخلايا الجذعية المشتقة من الدهون تجديد الأعصاب المحيطية: يعزز BDNF الذي تفرزه هذه الخلايا شفاء الأعصاب ونمو المحاور العصبية دي نوفو. PLoS ONE 6(3): e178991
[20] S. سيغو وآخرون، الخلايا التجددية المشتقة من الدهون غير المزروعة تعزز تجديد الأعصاب الطرفية، مجلة علوم تقويم العظام، المجلد 18، العدد 1، 2013، الصفحات 145-151
[21] سي ف. بورلونجان وآخرون نفاذ الحاجز الدموي الدماغي وإبطال الالتهاب في السكتة الدماغية: الآثار المترتبة على علاج السكتة الدماغية Curr Pharm Des. 2012; 18(25): 3670-3676
[22] Sakthiswary R، Raymond AA. العلاج بالخلايا الجذعية في الأمراض العصبية التنكسية: من المبادئ إلى الممارسة. Neural Regen Res. 2012; 7(23):1822-1831. doi:10.3969/j.issn.1673-5374.2012.23.009
[23] Lunn JS, Sakowski SA, Hur J, Feldman EL. تقنية الخلايا الجذعية للأمراض العصبية التنكسية. Ann Neurol. 2011;70(3):353–361. doi:10.1002/ana.22487