Quel est le point commun entre les cellules souches du cordon ombilical et les nacelles de marée ?
 "Les gens demandent souvent si les cellules souches fonctionnent. Bien sûr qu'elles fonctionnent. Nous sommes tous des produits de cellules souches ambulantes - le sperme et l'ovule", a déclaré le vénérable James Willerson, docteur en médecine, lors d'une conférence en 2011.[1]
"Les gens demandent souvent si les cellules souches fonctionnent. Bien sûr qu'elles fonctionnent. Nous sommes tous des produits de cellules souches ambulantes - le sperme et l'ovule", a déclaré le vénérable James Willerson, docteur en médecine, lors d'une conférence en 2011.[1]
La mode alimentaire des adolescents, Gronk et la psychologie inversée de Tide Pod
Qu'ont en commun les dentistes, les chiropracteurs, les médecins anti-âge, le Four Seasons Maui Spa et la mode alimentaire des Tide Pods ?

En 2018, le La mode des adolescents qui mangent des sachets Tide Pods a entraîné 10 décès et 37 cas d'empoisonnement signalés.
Proctor and Gamble, le fabricant de Tide, est passé à l'offensive pour empêcher les enfants de s'empoisonner.
Ils ont même engagé la superstar de la NFL Rob Gronkowski pour qu'il revienne au score dans les moments décisifs, comme il l'avait fait pour remporter quatre Super Bowls avec Tom Brady. Cependant, L'admonestation de Gronk sur YouTube Tide Pod a permis à un plus grand nombre d'adolescents de relever le défi.
Contamination, FDA et psychologie inversée
Le 5 décembre 2019, la FDA a mis en garde Liveyon Labs, Inc. qu'ils vendaient des produits à base de cellules souches de cordon ombilical contaminés et non approuvés. Au moins 300 patients ont signalé des infections bactériennes liées aux produits à base de cellules souches de cordon ombilical de Liveyon.
Un jour plus tard, l'agence a publié un communiqué de presse informer les fabricants, les fournisseurs et le public des problèmes de Liveyon et de la portée plus large de leurs préoccupations. Les autres bénéficiaires sont RichSource Stem Cells, Inc., Chara Biologics, Inc.et R3 Stem Cell, LLC. Au total, la FDA a publié 350 lettres d'avertissement aux fabricants, aux prestataires de soins de santé et aux cliniques.
Le résultat : De plus en plus, les chiropracteurs, les dentistes, les naturopathes, les médecins intégratifs, les cliniques de perfusion, les orthopédistes, etc. traitent les patients avec des cellules souches mortes non approuvées, potentiellement contaminées.
Qui a tué les cellules souches ? Malheureusement, comme l'a raconté le patient d'un chiropracteur souffrant d'un longovidus et d'une insuffisance cardiaque congestive, "j'ai essayé les cellules souches du cordon ombilical. Elles n'ont pas fonctionné. Les études ont révélé qu'il n'y avait pas de cellules souches vivantes dans le produit avec lequel il a été traité ou dans d'autres flacons périnataux disponibles dans le commerce :
Malheureusement, comme l'a raconté le patient d'un chiropracteur souffrant d'un longovidus et d'une insuffisance cardiaque congestive, "j'ai essayé les cellules souches du cordon ombilical. Elles n'ont pas fonctionné. Les études ont révélé qu'il n'y avait pas de cellules souches vivantes dans le produit avec lequel il a été traité ou dans d'autres flacons périnataux disponibles dans le commerce :
- La viabilité des cellules dans le produit de sang de cordon était inférieure à celle indiquée par le fabricant, les cellules étaient principalement des leucocytes, aucune cellule souche n'était présente..."[2]
- L'approche commerciale agressive actuellement utilisée par les praticiens et les cliniques concernant divers produits de tissus de naissance en tant que "thérapie par cellules souches" sûre et efficace n'est pas étayée par la littérature scientifique existante. [3]
- Les CFU-F, souvent appelées cellules souches, n'ont été trouvées dans aucun des produits commerciaux d'allogreffes de cordon ombilical analysés, et les cliniciens doivent se méfier des allégations commerciales qui affirment le contraire. [4]
- Le liquide amniotique a été proposé comme moyen allogène d'introduire des CSM. Cette étude n'a pas pu confirmer que les AFP commerciaux (produits à base de liquide amniotique) contiennent des CSM. [5]
Appétence pour le risque
Mais quel est le lien entre l'engouement pour la consommation de Tide Pod et l'engouement pour les cellules souches du cordon ombilical ? Les adolescents qui mangent des Tide Pods et les patients qui reçoivent des cellules souches du cordon ombilical ont le même goût du risque :
- Plus Proctor and Gamble mettait en garde les enfants contre le danger de manger des Tide Pods, plus l'engouement se développait rapidement.
- Plus la FDA met en garde les prestataires et les patients contre les risques liés aux cellules souches périnatales et à leurs exosomes, plus l'engouement devient frénétique.
Une étude réalisée en 2016 a recensé 351 entreprises proposant des traitements à base de cellules souches. Cinq ans plus tard, le même auteur estime que plus de quatre fois plus d'entreprises (1 480) vendent des traitements à base de cellules souches, dont environ la moitié (781) font la promotion de traitements à base de cellules ombilicales, amniotiques ou d'exosomes. [6]
Nous reviendrons plus tard sur la prise de risque. Tout d'abord, qu'est-ce que les "cellules souches périnatales" ?
Cellules souches périnatales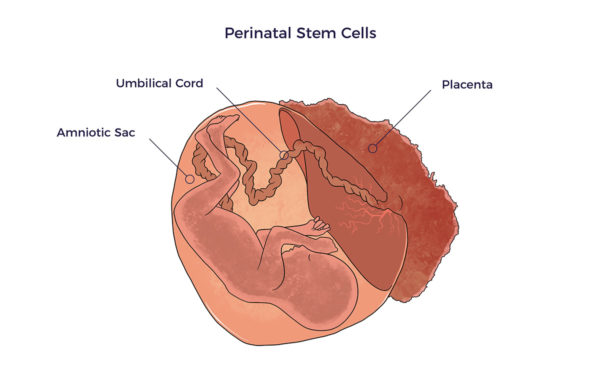 Le terme périnatal fait référence à la période qui précède ou suit de peu la naissance. Ainsi, les cellules souches périnatales proviennent des tissus ou des fluides de la naissance, c'est-à-dire..., cordon ombilical le sang et les tissus, placentaire le sang et les tissus, et amniotique les tissus et les fluides.
Le terme périnatal fait référence à la période qui précède ou suit de peu la naissance. Ainsi, les cellules souches périnatales proviennent des tissus ou des fluides de la naissance, c'est-à-dire..., cordon ombilical le sang et les tissus, placentaire le sang et les tissus, et amniotique les tissus et les fluides.
Cela semble être une bonne chose à première vue, mais comme l'explique le document Le débat sur les sources cellulairesLes cellules souches mésenchymateuses (CSM) sont rares dans les tissus et les liquides de l'accouchement. Nous reviendrons sur cette partie de l'histoire.
Exosomes Les cellules libèrent de minuscules sacs ou vésicules appelés exosomes. Comme des pigeons voyageurs, les exosomes transmettent des messages aux cellules voisines.
Les cellules libèrent de minuscules sacs ou vésicules appelés exosomes. Comme des pigeons voyageurs, les exosomes transmettent des messages aux cellules voisines.
Toutes les cellules contenant de l'ADN - cellules cancéreuses, tissulaires, immunitaires, sanguines, etc. sécrètent des exosomes.
Les cellules souches mésenchymateuses (CSM) les libèrent également. Malgré l'absence d'études comparatives sur l'homme, ce mécanisme a conduit certains chercheurs et amateurs de cellules souches à penser qu'elles sont plus efficaces que les CSM ou les ADRC.
Et alors qu'une dose thérapeutique de CSM peut être de 40 à 100 millions de cellules, les fabricants d'exosomes prétendent que leurs flacons en contiennent des centaines de millions. Un "médecin spécialiste des cellules souches" du sud de la Floride vante un milliard de flacons d'exosomes - sans qu'il soit prouvé que plus c'est mieux, et encore moins que c'est stérile ou sûr.
Les techniciens de laboratoire doivent multiplier les CSM ou les exosomes en culture pour obtenir une dose pertinente. Cependant, le maintien des bonnes pratiques de fabrication (cGMP) exige le respect de normes rigoureuses.
Qui est le coupable ?

Le polar en dix épisodes de Wondery, Mauvais lotLe rapport de la Commission européenne sur la sécurité des produits pharmaceutiques illustre les risques importants pour la sécurité des patients liés à la commercialisation astucieuse de Liveyon et aux pratiques de laboratoire non stériles. Au total, plus de 200 patients ont signalé des effets indésirables graves.
En outre, les CDC ont publié les résultats de leurs analyses dans le Journal of the American Medical Association (JAMA) en 2021.
Points clés
Question Les infections chez les patients qui ont reçu des produits à base de sang de cordon ombilical commercialisés en tant que traitement à base de cellules souches associés à une contamination du produit ?
Résultats Dans cette série de casDans le cadre d'une enquête nationale, 20 patients dans 8 États ont contracté des infections bactériennes après avoir reçu des produits non homologués commercialisés comme traitement pour des affections telles que des douleurs chroniques et des affections articulaires dégénératives. Cette enquête nationale a révélé une contamination bactérienne généralisée de produits non distribués et distribués par de multiples donneurs, le séquençage du génome entier indiquant une source commune.
Signification Les résultats de cette épidémie soulignent que les produits à base de cellules souches non approuvés et non éprouvés peuvent exposer les patients à des risques graves sans bénéfice clair, y compris la possibilité d'une contamination du produit.
Parmi les produits non ouverts et non distribués échantillonnés pour les tests, au moins 1 des 16 espèces bactériennes a contaminé 65% (22 des 34 flacons). [7]
Réincarnations de Liveyon
Pourtant, les avertissements n'ont pas permis d'endiguer la marée de cellules souches du cordon ombilical (UBSC) ni d'éliminer les cellules souillées :
- Lettre d'avertissement de la banque de cordons ombilicaux de l'Utah pour mai 2021
- Vitti Health Lettre d'avertissement de juillet 2022
- Invitrix Nov 2022 Lettre d'avertissement
D'un point de vue non abordé par la FDA, un examen global de la littérature scientifique une quarantaine d'études ont révélé la présence de "produits chimiques à vie" provenant de plastiques toxiques dans 30 000 échantillons de sang de cordon ombilical.
En outre, en citant les rapports de patients sur les effets indésirables d'une étude de Nebraska exosome clinique, la FDA a émis un avertissement de sécurité au public.
Qu'est-ce que l'arthrite réactive après une injection de "cellules souches" ?
Les promoteurs des produits à base de "cellules souches" périnatales affirment qu'il n'y a pas de risque de rejet immunitaire. En d'autres termes, ils affirment que la gelée de Wharton du cordon ombilical ne nécessite pas d'appariement des antigènes leucocytaires humains (HLA) pour apparier les patients et les donneurs, comme c'est le cas pour les greffes de sang ou de moelle.
Cependant, un rapport de cas non concordant contredit leur fausse affirmation.
"Un homme de 36 ans s'est vu injecter de la gelée de Wharton pour des douleurs lombaires et a développé dans les 24 heures des fièvres, des frissons, une polyarthrite et une enthésite. (L'enthésite est une inflammation de l'enthèse, c'est-à-dire de l'endroit où un tendon ou un ligament s'attache à un os..) Le bilan infectieux est négatif. Les marqueurs inflammatoires sont élevés et l'antigène HLA-B27 est positif. Le traitement initial comprenait de la méthylprednisolone et de la sulfasalazine. Ce cas met en évidence les dangers inconnus de ces injections allogéniques et les médecins devraient rester prudents quant à leur utilisation jusqu'à ce que de nouvelles études et réglementations puissent garantir la sécurité des patients".[8]
Un pénitencier ouvert ?
Si ces produits ne sont pas approuvés par la FDA et que les laboratoires ne respectent pas les bonnes pratiques de fabrication, comment les entreprises peuvent-elles s'en sortir en les vendant ? Les fabricants prétendent que leurs produits sont destinés à la recherche ou ignorent les réglementations de la FDA parce qu'ils s'en moquent éperdument.
- Invitrix et Laboratoires Vitti utiliser les clauses de non-responsabilité pour garder une longueur d'avance sur la loi.
- Organicell se cache derrière le voile de plusieurs essais cliniques de phase 1 prévus ou en cours.
Tout le monde accélère Un médecin désireux de participer au "wild, wild west" des cellules souches a demandé à un avocat spécialisé dans les affaires réglementaires relatives aux cellules souches :
Un médecin désireux de participer au "wild, wild west" des cellules souches a demandé à un avocat spécialisé dans les affaires réglementaires relatives aux cellules souches :
Médecin : Si j'ai besoin d'une autorisation réglementaire pour traiter les patients avec des cellules souches, comment se fait-il que tant de médecins le fassent de toute façon ?
Avocat : "Faites-vous des excès de vitesse ?"
Médecin : "Tout le temps".
Avocat : "Est-ce illégal ?"
Médecin : "Je m'en fiche".
Des histoires comme Un jury condamne un législateur de l'État pour une fraude au COVID-19 au sein d'une organisation caritative de soins de santé à Springfield et Un homme prétendant faussement utiliser la "thérapie par cellules souches" est condamné à 202 ans de prison ne semblent pas faire de différence.
Les cellules souches et les exosomes au service de la santé et de la richesse
NextSanté au Four Seasons Maui Resort mélange la manie en proposant dans son spa les "cellules souches" de cordon ombilical potentiellement contaminées de Vitti Labs et les exosomes non approuvés d'Organicell. Ils proposent Cellules souches + Exosomes + Thérapie IV de longévité pour $.16 000, soit une économie de $2 299.
 Contrairement aux lettres d'avertissement de la FDA, une coordinatrice des patients de NextHealth a insisté sur le fait que les produits Vitti et Organicell sont approuvés par la FDA et que les fabricants certifient que tous les lots sont exempts de contaminants. D'où lui vient cette idée ?
Contrairement aux lettres d'avertissement de la FDA, une coordinatrice des patients de NextHealth a insisté sur le fait que les produits Vitti et Organicell sont approuvés par la FDA et que les fabricants certifient que tous les lots sont exempts de contaminants. D'où lui vient cette idée ?
D'un autre point de vue, ce n'est pas parce que quelque chose est illégal que les spécialistes du marketing astucieux qui s'associent à des marques emblématiques telles que Four Seasons ont consulté un avocat spécialisé dans la conformité à la FDA. Ou qu'ils ont lu la littérature citée dans le présent document.
Le distributeur de cellules souches développe les cabinets dentaires A l'autre bout du spectre, Nouvelle vieInvitrix, distributeur d'Organicell, "travaille en étroite collaboration avec les cliniciens et les praticiens pour améliorer leurs offres de soins... et étendre leurs pratiques avec ".produits biologiques naturels (souligné par l'auteur)". Mais leur page des produits de recherche et une clause de non-responsabilité indiquent à leurs clients - dentistes, chiropracteurs, infirmières et médecins - que leurs produits ne sont pas approuvés par la FDA.
A l'autre bout du spectre, Nouvelle vieInvitrix, distributeur d'Organicell, "travaille en étroite collaboration avec les cliniciens et les praticiens pour améliorer leurs offres de soins... et étendre leurs pratiques avec ".produits biologiques naturels (souligné par l'auteur)". Mais leur page des produits de recherche et une clause de non-responsabilité indiquent à leurs clients - dentistes, chiropracteurs, infirmières et médecins - que leurs produits ne sont pas approuvés par la FDA.
Les cellules souches sont-elles efficaces ? "Bien sûr, elles fonctionnent. Nous sommes tous des produits de cellules souches ambulantes - le sperme et l'ovule". James Willerson, MD, Ph.D. Le Dr Willerson a ensuite publié Buying New Soul (2012). Il y émet l'hypothèse que le tissu adipeux est la meilleure source de cellules souches adultes.
"Bien sûr, elles fonctionnent. Nous sommes tous des produits de cellules souches ambulantes - le sperme et l'ovule". James Willerson, MD, Ph.D. Le Dr Willerson a ensuite publié Buying New Soul (2012). Il y émet l'hypothèse que le tissu adipeux est la meilleure source de cellules souches adultes.
De plus en plus d'ouvrages soutiennent l'hypothèse de Willerson : Une recherche sur PubMed Central a retrouvé plus de 100 000 publications traitant des cellules souches dérivées de l'adipeuse. Et plus de 35 études publiées sur le système Celution chez l'homme valider la sécurité et l'efficacité des ADRC de qualité clinique.
En revanche, l'expérimentation sur des patients dans des cabinets dentaires ou des hôtels de luxe avec des "produits biologiques naturels" potentiellement contaminés contenant des cellules souches mortes est une gousse risquée à avaler pour les patients.
[2] Fortier LA, Cercone M, Keller LE, Delco ML, Becktell L, Wells KV. Produits dérivés de l'amnios et du cordon ombilical en médecine sportive : De la science fondamentale à l'application clinique. The American Journal of Sports Medicine (en anglais). 2021;49(7):1954-1961
[3]https://legislature.vermont.gov/Documents/2020/WorkGroups/Senate%20Health%20and%20Welfare/Bills/S.252/Written%20Testimony/S.252~Jonathan%20Fenton~Consensus%20Statement%20on%20Aggressive%20Marketing%20of%20Birth%20Tissues%20as%20Stem%20Cell%20Therapies~2-28-2020.pdf
[4] Berger DR, Centeno CJ, Kisiday JD, McIlwraith CW, Steinmetz NJ. Colony Forming Potential and Protein Composition of Commercial Umbilical Cord Allograft Products in Comparison with Autologous Orthobiologics. Am J Sports Med. 2021 Oct;49(12):3404-3413.
[5] Panero AJ, Hirahara AM, Andersen WJ, Rothenberg J, Fierro F. Are Amniotic Fluid Products Stem Cell Therapies ? A Study of Amniotic Fluid Preparations for Mesenchymal Stem Cells with Bone Marrow Comparison. The American Journal of Sports Medicine. 2019;47(5):1230-1235.
[6] Turner L The American stem cell sell in 2021 : U.S. businesses selling unlicensed and unproven stem cell interventions Cell Stem Cell 28, November 4, 2021
[7] Hartnett KP, Powell KM, Rankin D, et al. Investigation of Bacterial Infections Among Patients Treated with Umbilical Cord Blood-Derived Products Marketed as Stem Cell Therapies (Enquête sur les infections bactériennes chez les patients traités avec des produits dérivés du sang de cordon ombilical commercialisés en tant que thérapies à base de cellules souches). JAMA Netw Open.2021;4(10) : e2128615.
[8] Madhoun et al. Induction of HLA-B27-Associated Reactive Arthritis After a Wharton's Jelly "Stem Cell" Injection Am J Phys Med Rehabil 2020;99:e142-e145






