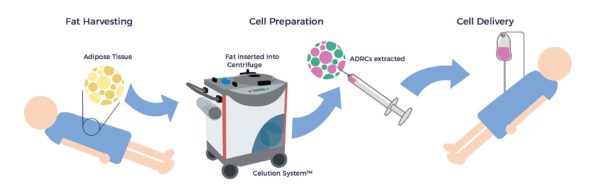
Thérapie cellulaire AMBROSE pour les maladies rénales
En 2010, comme c'est généralement le cas dans un nouveau domaine de recherche, un groupe de scientifiques a réalisé une étude animale pour tester la sécurité et l'efficacité potentielles des cellules souches et régénératives dérivées de l'adipeuse (de la graisse) pour traiter les maladies rénales aiguës.
Les résultats ont été étonnamment positifs, démontrant que la thérapie ADRC réduisait drastiquement la mortalité avec 100% des souris traitées survivant contre 57% ayant reçu le placebo (contrôles). De même, les souris traitées présentaient des taux de créatinine sérique significativement réduits par rapport aux témoins.[1] Depuis cette étude, une série d'autres études sur les maladies rénales aiguës et chroniques chez les petits et grands animaux ainsi que chez l'homme ont montré que les cellules souches adultes et d'autres cellules régénératrices du tissu adipeux peuvent potentiellement aider à prévenir la progression de la maladie, à abaisser les taux de créatinine sérique, à inverser la cicatrice fibreuse (fibrose) et à améliorer la circulation sanguine.[2] [3] [4] Des études humaines ont également montré une amélioration de la fonction rénale après un traitement par cellules souches.[5]
Cellules souches et régénératives dérivées de l'adipeuse (ADRC)
La graisse corporelle, connue sous le nom médical de tissu adipeux, est une source intéressante de cellules souches et régénératives en raison de son accessibilité, de son abondance et de sa puissance par rapport à d'autres sources de tissus telles que la moelle osseuse, le cordon ombilical et le placenta. Les ADRC peuvent être prélevées, traitées et réinjectées au chevet du patient en une seule journée. Grâce à leurs multiples activités biologiques, elles ont été utilisées pour améliorer les symptômes, la fonction et la qualité de vie dans un large éventail de conditions, y compris les maladies rénales aiguës et chroniques.[6] [7]
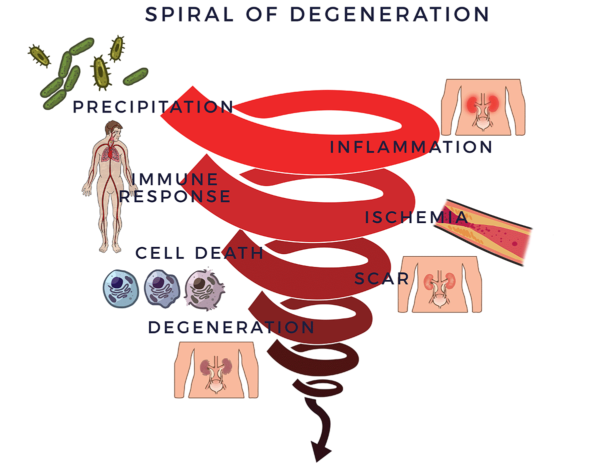
La spirale de la dégénérescence
Les affections dégénératives chroniques, dont l'insuffisance rénale, suivent un schéma similaire dans leur processus pathologique.
Un traumatisme, une infection, des toxines environnementales, un mode de vie malsain (par exemple le tabagisme), des facteurs héréditaires ou une combinaison de ces facteurs négatifs peuvent déclencher une réponse inflammatoire. Ce type d'inflammation (aiguë) est essentiel à la réparation de l'organisme et est généralement de courte durée, disparaissant une fois que le processus de guérison a eu lieu.
Il existe un autre type de réaction inflammatoire persistante qui devient chronique et affecte l'ensemble de l'organisme, devenant systémique.[8] L'inflammation systémique est un facteur courant dans les maladies du vieillissement, ce qui couvre un large éventail d'affections graves, débilitantes et parfois mortelles, y compris l'insuffisance rénale.[9] [10]
Dans le cas des maladies dégénératives, l'inflammation chronique déclenche un processus dégénératif vicieux. Elle recrute le système immunitaire, dont le rôle est de lutter contre les infections et autres processus pathologiques, et de contribuer à la guérison. Les cellules du système immunitaire (cellules immunitaires) ont pour mission de protéger l'organisme. Lorsqu'elles détectent un ennemi, elles envoient des troupes de molécules pro-inflammatoires appelées “cytokines” pour le combattre. Lorsque ce processus échappe à tout contrôle, on parle de réaction inflammatoire-immune. Cette réponse équivaut à avoir un conducteur arrière qui réagit de manière chroniquement excessive tout en vous “aidant” à conduire votre voiture. La réponse immunitaire entraîne alors une réduction de la circulation sanguine (ischémie). Sans une bonne circulation, les cellules meurent, des cicatrices et des fibroses se forment, les tissus et les organes dégénèrent. C'est ce que nous appelons la spirale de la dégénérescence et nous l'utilisons comme cadre pour comprendre certains des facteurs clés de la maladie rénale.
La perte de la fonction rénale correspond à une inflammation affectant le système de filtration des reins et leurs petits vaisseaux sanguins. Il est bien connu que la maladie rénale chronique est associée au diabète et à une hypertension artérielle non contrôlée, ce qui aggrave progressivement la fonction rénale au fil du temps. Les premiers stades ne présentent généralement aucun symptôme. La néphropathie aiguë peut être rapidement provoquée par un état hydrique insuffisant (dû à diverses affections) et par certains médicaments.
Processus de réparation
Par le biais d'un mécanisme de communication intercellulaire connu sous le nom d'effet paracrine, les ADRC mobilisent les cellules voisines pour qu'elles travaillent plus efficacement. Elles recrutent les services biologiques d'incendie, de secours et de réparation du site - les cellules souches résidentes - pour qu'ils se remettent au travail et fassent leur part.
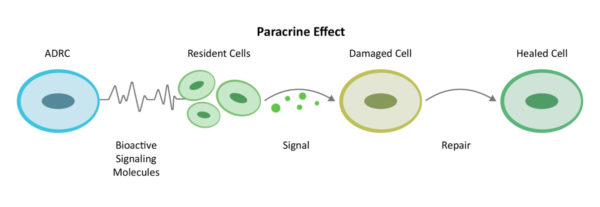
En recrutant d'autres "réparateurs" sur le site (cellules souches résidentes) pour qu'ils reprennent le travail et fassent leur part, les ADRC forment une équipe élargie et travaillent d'abord à la réduction de l'inflammation et des réponses immunitaires hyperactives. Une fois que la conduite sur la banquette arrière diminue, ils poursuivent leur travail en augmentant la circulation grâce à la croissance de nouveaux vaisseaux sanguins, en empêchant toute nouvelle mort cellulaire, en s'attaquant au tissu cicatriciel et en régénérant les tissus sains et les nerfs. C'est ainsi que le corps guérit naturellement, mais si l'insulte causée par une affection aiguë ou chronique est trop importante, il a besoin d'aide.
C'est ce que nous appelons le processus de réparation. Il implique les multiples mécanismes d'action nécessaires pour rééquilibrer l'inflammation systémique et la réponse immunitaire.
Thérapie cellulaire AMBROSE pour les maladies rénales
Étant donné que les principaux facteurs de la spirale mentionnés ci-dessus sont impliqués dans l'insuffisance rénale et qu'il a été démontré que les multiples mécanismes de réparation des ADRC inversent ces effets dans cette pathologie ainsi que dans une série d'autres pathologies graves, les patients souffrant de maladies rénales peuvent potentiellement bénéficier de la thérapie cellulaire d'AMBROSE.
Des études animales ont montré que les cellules souches réduisent les lésions rénales aiguës en activant des globules blancs spécialisés qui initient la cicatrisation et la réparation des tissus rénaux, et protègent contre le vieillissement prématuré des cellules.[11] [12] [13]
De même, il a été démontré que le traitement par cellules souches des maladies rénales chroniques chez l'animal favorise la récupération de la production d'énergie des cellules rénales[14] [15], Diminution de la cicatrisation[16], et de diminuer l'inflammation.[17]
La thérapie cellulaire AMBROSE représente une option de traitement peu invasive pour les patients souffrant de maladies rénales. Veuillez nous contacter pour plus d'informations sur le traitement, la candidature et la manière de devenir un patient.
[1] Z Feng et al Fresh and cryopreserved, uncultured adipose tissue-derived stem and regenerative cells ameliorate ischemia-reperfusion-induced acute kidney injury, Néphrologie Dialyse Transplantation, Volume 25, Issue 12, 1 December 2010, Pages 3874-3884
[2] C Donizetti-Oliveira Adipose Tissue-Derived Stem Cell Treatment Prevents Renal Disease Progression Cell Transplantation, Vol. 21, pp. 1727-1741, 2012
[3] A Eirin et al Adipose tissue-derived mesenchymal stem cells improve revascularization outcomes to restore renal function in swine atherosclerotic renal artery stenosis Stem Cells. 2012 May ; 30(5) : 1030-1041
[4] JJ Rivera-Valdés et al. (2017) Human adipose derived stem cells regress fibrosis in a chronic renal fibrotic model induced by adenine. PLoS ONE 12(12)
[5] El-Ansary M, Saadi G, Abd El-Hamid SM. Les cellules souches mésenchymateuses sont une approche de sauvetage pour la récupération de la détérioration de la fonction rénale. Nephrology 2012;17:650-657.
[6] Guo et al Stromal vascular fraction : Une réalité régénératrice ? Part 2 : Current concepts and review of the literature Journal of Plastic, Reconstructive & Aesthetic Surgery (2016) 69, 180e188
[7] JK Fraser PhD et S Kesten MD Autologous Adipose Derived Regenerative Cells : Une plateforme pour des applications thérapeutiques Cicatrisation avancée Technologie chirurgicale internationale XXIX
[8] S. Amor Inflammation dans les maladies neurodégénératives Immunologie, 129, 154-169
[9] C. Franceschi and J. Campisi Chronic Inflammation (Inflammaging) and Its Potential Contribution to Age-Associated Diseases J Gerontol A Biol Sci Med Sci 2014 June;69(S1) : S4-S9
[10] Suliman ME, Stenvinkel P. Contribution de l'inflammation à la maladie vasculaire chez les patients atteints de maladie rénale chronique. Saudi J Kidney Dis Transpl 2008;19:329-45
[11] Geng, Y. ; Zhang, L. ; Fu, B. ; Zhang, J. ; Hong, Q. ; Hu, J. ; Li, D. ; Luo, C. ; Cui, S. ; Zhu, F. ; et al. Mesenchymal stem cells ameliorate rhabdomyolysis-induced acute kidney injury via the activation of m2 macrophages. Stem Cell Res. Ther. 2014, 5, 80
[12] Lee, S.J. ; Ryu, M.O. ; Seo, M.S. ; Park, S.B. ; Ahn, J.O. ; Han, S.M. ; Kang, K.S. ; Bhang, D.H. ; Youn, H.Y. Les cellules souches mésenchymateuses contribuent à l'amélioration de la fonction rénale dans un modèle de lésion rénale canine. In Vivo 2017, 31, 1115-1124
[13] Rodrigues, C.E. ; Capcha, J.M. ; de Braganca, A.C. ; Sanches, T.R. ; Gouveia, P.Q. ; de Oliveira, P.A. ; Malheiros, D.M. ; Volpini, R.A. ; Santinho, M.A. ; Santana, B.A. ; et al. Human umbilical cord-derived mesenchymal stromal cells protect against premature renal senescence resulting from oxidative stress in rats with acute kidney injury. Stem Cell Res. Ther. 2017, 8, 19
[14] Yoon, Y.M. ; Han, Y.S. ; Yun, C.W. ; Lee, J.H. ; Kim, R. ; Lee, S.H. La pioglitazone protège les cellules souches mésenchymateuses contre le dysfonctionnement mitochondrial induit par le p-crésol via l'augmentation de la régulation de pink-1. Int. J. Mol. Sci. 2018, 19, 2898
[15] Lira, R. ; Oliveira, M. ; Martins, M. ; Silva, C. ; Carvalho, S. ; Stumbo, A.C. ; Cortez, E. ; Verdoorn, K. ; Einicker-Lamas, M. ; Thole, A. ; et al. La transplantation de mscs dérivées de la moelle osseuse améliore la fonction rénale et l'activité na(+)+k(+)-atpase chez les rats atteints d'hypertension rénovasculaire. Cell Tissue Res. 2017, 369, 287-301
[16] Wu, H.J. ; Yiu, W.H. ; Li, R.X. ; Wong, D.W. ; Leung, J.C. ; Chan, L.Y. ; Zhang, Y. ; Lian, Q. ; Lin, M. ; Tse, H.F. ; et al. Mesenchymal stem cells modulate albumin-induced renal tubular inflammation and fibrosis. PLoS ONE 2014, 9, e90883
[17] Abdel Aziz, M.T. ; Wassef, M.A. ; Ahmed, H.H. ; Rashed, L. ; Mahfouz, S. ; Aly, M.I. ; Hussein, R.E. ; Abdelaziz, M. Le rôle des cellules souches mésenchymateuses dérivées de la moelle osseuse dans l'atténuation de la fonction rénale chez les rats atteints de néphropathie diabétique. Diabetol. Metab. Syndr. 2014, 6, 34