Biodistribution des cellules souches adultes
Biodistribution des cellules souches adultes
Cellules souches mésenchymateuses
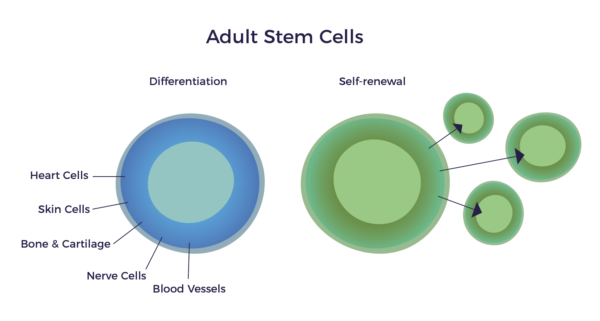
En 1991, le professeur Arnold Caplan a publié l'article fondateur "Mesenchymal Stem Cells (MSCs)" (cellules souches mésenchymateuses). Dans cet article, il décrit les CSM comme ayant la capacité de se différencier et de s'auto-renouveler en de multiples types de tissus, ainsi qu'en neurones et en vaisseaux sanguins. [1] En d'autres termes, elles sont "multipotentes", ce qui signifie qu'elles peuvent produire plus d'un type de cellule spécialisée du corps, mais pas tous les types. La différenciation et l'auto-renouvellement sont les caractéristiques uniques requises pour qu'une cellule soit une cellule souche.
Dans l'introduction de l'article, il qualifie les CSM de "base pour l'émergence d'une nouvelle technologie thérapeutique d'autoréparation cellulaire" (c'est nous qui soulignons). Ses recherches inlassables ont été largement soutenues par des centaines d'autres scientifiques. En fait, selon un PubMed Si l'on se réfère à la recherche sur les CSM, il existe aujourd'hui plus de 160 000 articles publiés qui traitent des CSM. Cette vaste littérature a permis de dégager un large consensus sur la manière dont ces cellules réparatrices migrent vers les tissus et organes malades et les réparent. La science a également progressé pour comprendre comment les CSM restaurent la fonction normale de nos systèmes vasculaire, immunitaire et endocrinien (hormones).
La recherche a progressé pour comprendre comment les CSM font leur travail (et a conduit à la proposition d'un nouveau nom pour ces cellules). Nous reviendrons plus tard sur ce nouveau nom, mais voici d'abord l'histoire.
Biodistribution
Depuis les premiers jours de la recherche sur les CSM, les scientifiques ont cherché à déterminer la voie d'acheminement optimale. Tout comme ils planifient le parcours le plus efficace dans une ville labyrinthique (comme Londres), ils veulent que nos cellules souches évitent les impasses, les rues à contresens et les itinéraires détournés. Les chercheurs reconnaissent également que certains itinéraires peuvent être plus risqués que d'autres, même s'ils semblent plus efficaces d'après la carte, par exemple l'injection directe de cellules souches dans le cerveau ou l'œil.
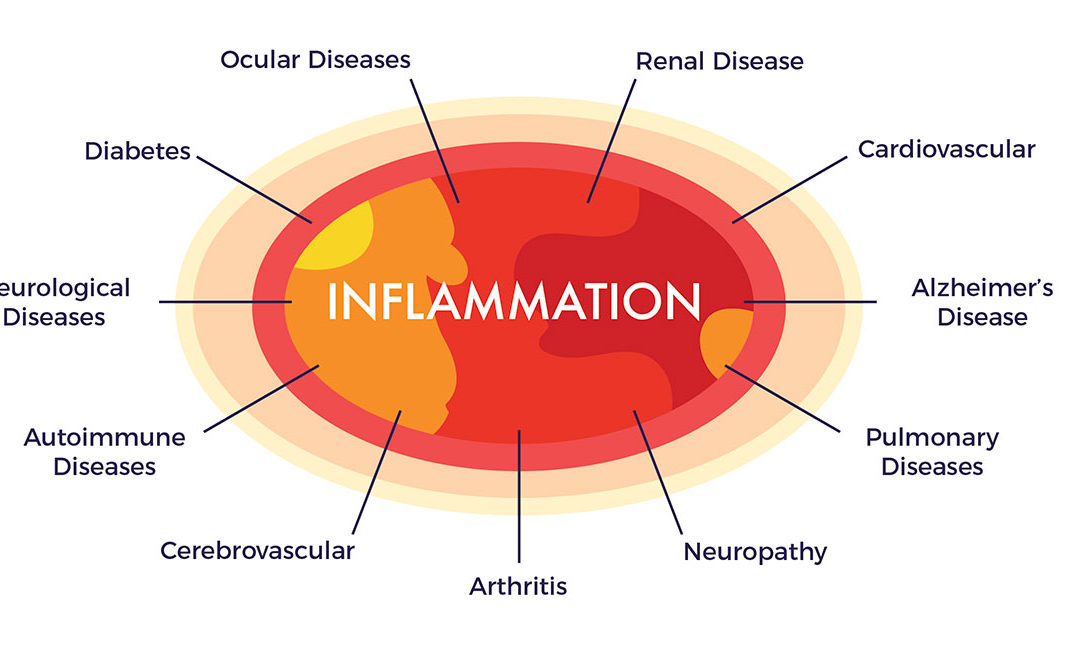
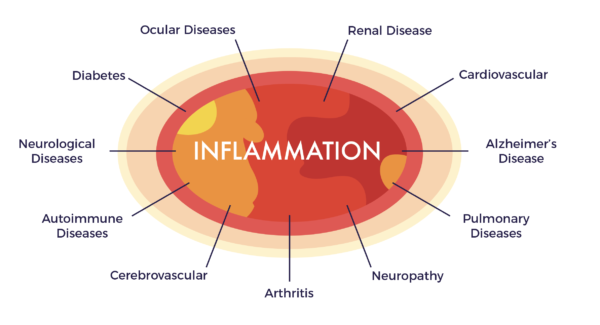
Mais il existe un nouvel aspect du processus de planification qui est de plus en plus apprécié par les chercheurs : Le rôle sous-jacent que joue l'inflammation systémique de bas niveau (inflammaging) dans les maladies chroniques et le potentiel des cellules souches pour calmer cette inflammation. Nous reviendrons plus tard sur l'inflammation ; tout d'abord, comment les CSM font-elles leur travail ?
Mécanismes d'action
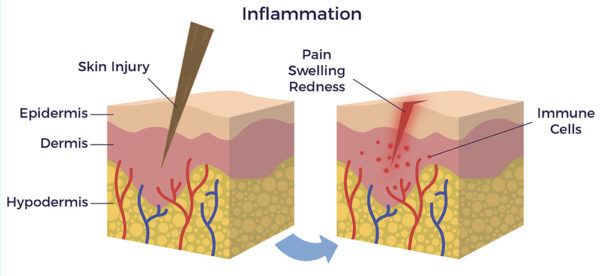
Le mécanisme d'action (MOA) fait référence à la manière dont nos cellules souches (ou nos médicaments) produisent leur effet. Dans le cas des CSM, leur MOA est analogue à celui des pompiers : Elles réagissent à une alarme incendie - c'est-à-dire à un signal inflammatoire - et se dirigent vers la source de l'alarme. Les CSM ont été appelées "gardiennes de l'inflammation". [2] Une fois sur les lieux de l'incendie, elles libèrent des centaines de molécules de signalisation bioactives appelées "cytokines". Les cytokines activent les cellules locales du voisinage pour qu'elles fassent leur travail. Cette communication de cellule à cellule s'appelle l'effet paracrine.
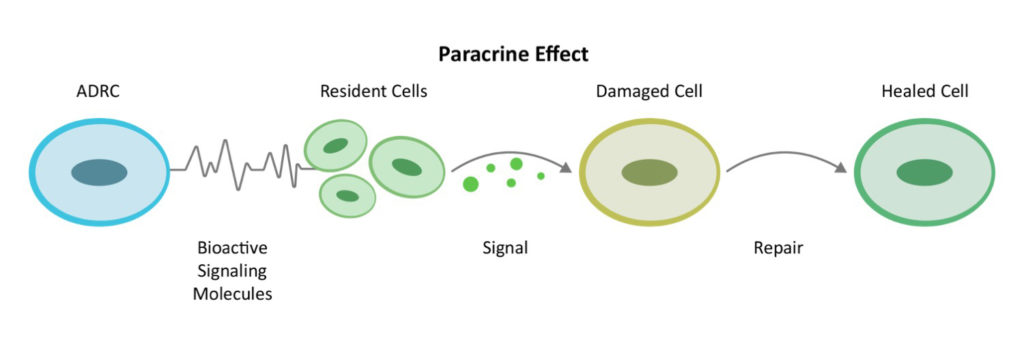
En bref, depuis la publication de l'article révolutionnaire du Dr Caplan, les chercheurs ont vérifié que le homing et l'effet paracrine sont les rôles centraux des CSM dans le processus de réparation. C'est pourquoi le professeur Caplan a proposé de changer le nom des CSM en "cellules de signalisation médicinale". [3]
Études de biodistribution
Les études de biodistribution ont établi que les cellules souches adultes administrées par voie intraveineuse migrent à travers les poumons et s'y "garent" ("effet de premier passage") - puis poursuivent leur chemin. (Il existe une certaine confusion quant à savoir si l'effet de premier passage est une "voie sans issue", mais il suffit de dire que la recherche a établi que ce n'est pas le cas). [4] [5] [6]
Poursuivant leur mission de lutte contre l'inflammation et de réparation de l'organisme, ils traversent le système vasculaire et les organes jusqu'à la rate, notre plus grand organe immunitaire. Elles empruntent ensuite le système lymphatique.
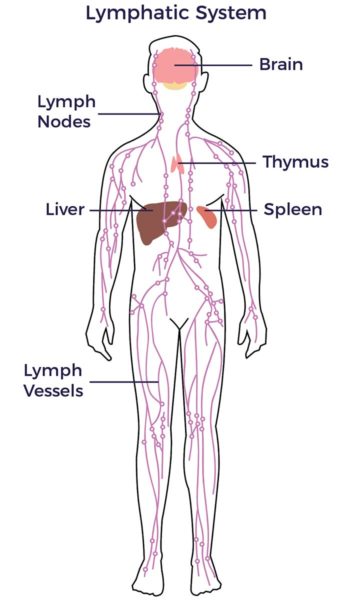
Le système lymphatique, parallèle au système vasculaire, est un élément essentiel du système immunitaire. Il transporte la lymphe (un liquide clair contenant un grand nombre de globules blancs appelés lymphocytes). Les lymphocytes combattent les infections et détruisent les cellules endommagées ou anormales. Ils sont abondants dans la population mixte de cellules prélevées dans notre tissu adipeux pour les thérapies cellulaires.
Études de biodistribution
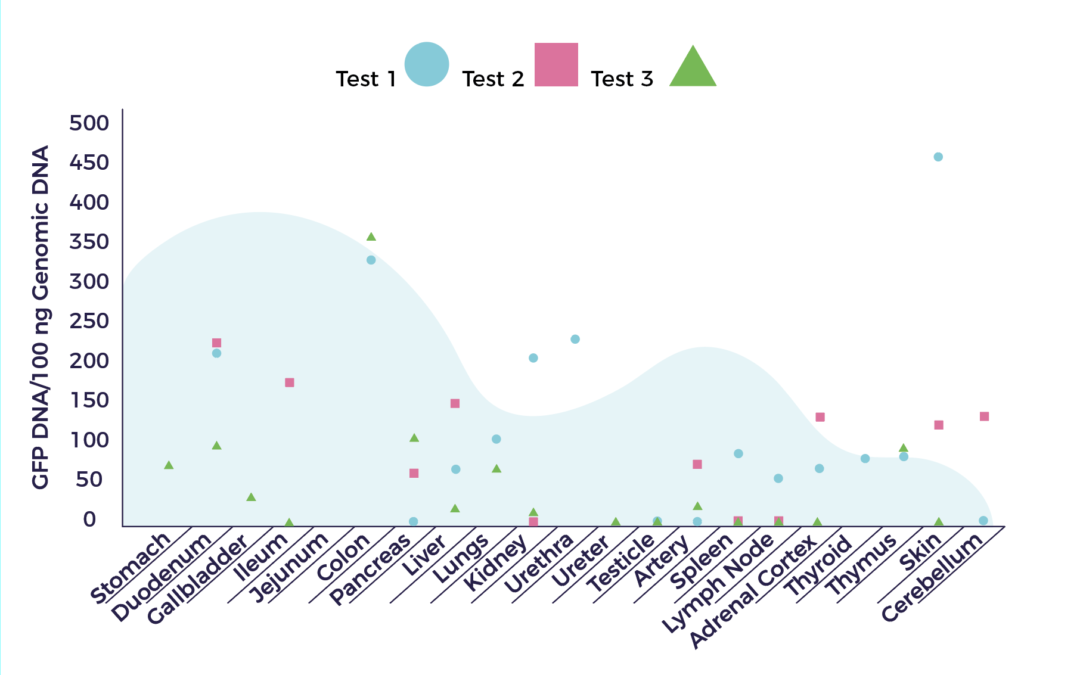
Une étude bien conçue sur l'infusion IV de cellules souches adultes chez les babouins a permis de suivre la migration. Le graphique ci-dessous montre la distribution dans tous les principaux organes internes du corps. [7]
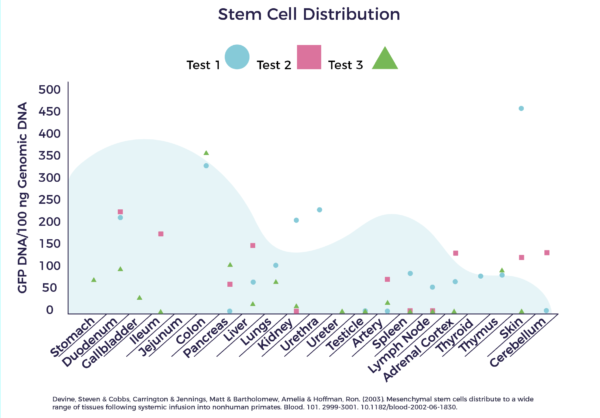
En outre, dans le cadre d'une étude sur la thérapie cellulaire cardiaque, des chercheurs du Texas Heart Institute et du MD Anderson ont suivi les cellules souches injectées dans le cœur de porcs. Ils ont également constaté que les CSM se déplaçaient à travers le système de vaisseaux sanguins jusqu'à la rate, puis continuaient à se déplacer à travers les lymphatiques. [8]
Par ailleurs, afin de ne pas négliger le potentiel d'autoréparation cellulaire, une étude menée sur des souris a montré que des cellules souches adultes administrées par voie systémique pouvaient réparer des lésions cornéennes induites par des produits chimiques, sans qu'aucune CSM ne soit directement appliquée sur la cornée. [9]
Résumé
Pour en savoir plus sur la raison pour laquelle AMBROSE accède aux CSM et autres cellules régénératrices de votre tissu adipeux, veuillez lire le document suivant Pourquoi le tissu adipeux ?. En reliant cela à notre Domaines d'intervention et Notre protocoleLes ADRC, administrés par voie intraveineuse, ont le potentiel d'atteindre tous les organes principaux et d'initier un processus de réparation.
[2] DJ Prockop et JY Oh Les CSM, gardiennes de l'inflammation Molecular Therapy Vol. 20 no. 1, 14-20 Jan. 2012
[3]A Caplan Les cellules souches mésenchymateuses : Il est temps de changer de nom ! Stem Cells Translational Medicine 2017;6:1445-1451
[Le passage pulmonaire est un obstacle majeur à l'administration intraveineuse de cellules souches : L'effet de premier passage pulmonaire
[5]AS Cornellisen et al Organ-specific migration of mesenchymal stromal cells : Qui, quand, où et pourquoi ? Immunology Letters 168 (2015) 159-169
[6]M El-Ensary et al Mesenchymal stem cells are a rescue approach for recovery of deteriorating kidney function Nephrology 17 (2012) 650-657
[7]S. Devine et al Les cellules souches mésenchymateuses se répartissent dans un large éventail de tissus à la suite d'une infection systémique.
Sang 15 avril 2003 Volume 101, Numéro 8 2999
[8]EC Perin et al. (2011) Imaging Long-Term Fate of Intramyocardially Implanted Mesenchymal Stem Cells in a Porcine Myocardial Infarction Model (Imagerie du devenir à long terme des cellules souches mésenchymateuses implantées par voie intramyocardique dans un modèle d'infarctus du myocarde porcin). PLoS ONE 6(9) : e22949.
[9]G Roddy et al Action at a Distance : Systemically Administered Adult Stem/Progenitor Cells (MSCs) Reduce Inflammatory Damage to the Cornea Without Engraftment and Primarily by Secretion of TNF-a Stimulated Gene/Protein 6 STEM CELLS 2011;29:1572-1579